【业绩】君实生物发布2019年度业绩
2019年是君实生物厚积薄发、锐意进取的一年。
我们在产品商业化、临床试验、管线扩张、生产基地建设等方面均取得重大进展。
公司首个上市产品抗PD-1单抗“拓益”自2月实现销售以来,公司开始呈现内生“造血”能力。为了让更多患者、更长期地从特瑞普利单抗治疗中获益,更广泛的适应症拓展正在积极进行中。截至目前,公司已在全球开展了超过30项特瑞普利单抗单药治疗及联合治疗的临床试验,包括14项关键注册临床试验,多瘤种研究进展在全球权威期刊和学术大会上发表。其中,特瑞普利单抗联合阿昔替尼治疗黏膜黑色素瘤更凭借早期突破性成果,获得美国FDA的“孤儿药”资格认定。
围绕“创新驱动”与“患者可及”,公司通过源头创新与合作引进,已将产品管线扩展至21项,产品类型增加了抗体药物偶联物(ADC)、融合蛋白等下一代创新疗法药物。其中,“全球新”肿瘤免疫药物JS004/TAB004抗BTLA单抗已于2019年实现“中美双报”,在全球启动临床试验;UBP1211(修美乐生物类似药)的NDA申请已获NMPA受理,有望成为公司第二个上市产品;JS005(IL-17A)获准进入临床;JS016(新冠病毒中和抗体)有望为抗击全球疫情提供创新抗体治疗选择。
在产业化方面,苏州吴江生产基地已完成产能升级,上海临港生产基地获得《药品生产许可证》并顺利投入试生产,至此,我们的总产能规模达到33,000L。相信在“全生命周期”质量体系的保障下,我们将加速达成多个产品商业化及临床用药的生产目标。
同时,为支持创新药研发项目的开展和科技产业化生产基地的建设,公司拟通过科创板上市募集资金。目前上市工作正在有序推进,已完成上交所问询工作。
凭借公司的自身研发平台优势和高效执行力,我们有信心力争每年在中国以及海外递交2~3个IND申请,加速推进现有临床阶段产品开发,并将进一步扩充公司的产品管线布局。
2020年伊始,全球面临疫情考验。为了保障肿瘤患者和受试者的用药权益,我们全力以赴,开通了一条条绿色通道。同时,我们正与科研机构合作开发中和抗体药,正面迎击新冠病毒。
立足中国,关注全球人类健康,这是我们的担当与责任!
财务|摘要
国际财务报告准则(IFRS)数额:
1
公司实现收入总额7.75亿元,主要来源于核心产品特瑞普利单抗(商品名:拓益)在2019年2月商业化后销量的攀升。
2
研发开支9.46亿元,同比增加75.8%。我们持续投入研发,推进关键临床试验,并同步启动了更多联合开发和权益引进项目,将研发管线扩展至小分子药物及抗体药物偶联物。
3
核心产品拓益的销售收入7.74亿元,其中,销售毛利88.3%,销售开支占销售收入占比约41.3%。
4
销售及分销开支3.20亿元,主要由于拓益推出及商业化所致。
5
投资活动所用现金净额9.52亿元,主要由于以下两方面投入:
投入临港生产基地建设,预计将让我们现有的产能提升十倍;
通过对外投资、许可引进以及联合开发等形式,进一步丰富研发管线上的产品类型。
业务|摘要
产品管线
利用自有完整开发平台与海内外合作开发,公司产品管线目前已扩展至21项在研产品,其中19项为创新药,2项为生物类似药,覆盖抗肿瘤、自身免疫、代谢类疾病、神经系统疾病和抗感染疾病领域。产品类型包含单抗、融合蛋白、ADC、小分子药物等多种类型。
截至2019年底,已有1项产品获得国家药品监督管理局(NMPA)的新药上市批准,9项产品获得NMPA的临床试验批准,2项产品获得美国食品药品监督管理局(FDA)的临床试验批准,12项产品处于临床前研究阶段。
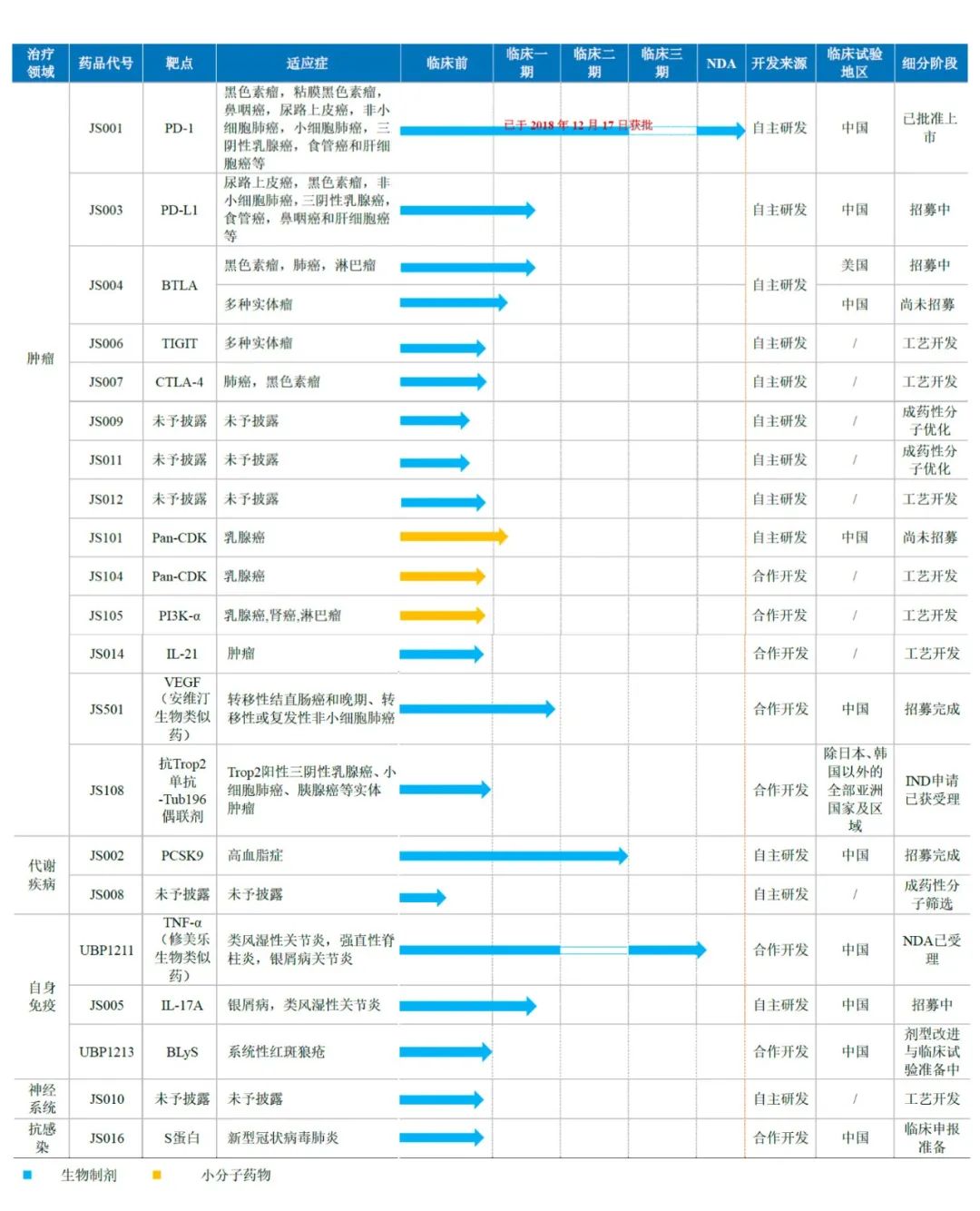
君实生物研发管线进展
特瑞普利单抗注射液(商品名:拓益,产品代号:JS001)
公司自主研发、第一个获NMPA批准上市的国产抗PD-1单抗
1
2019年2月,公司首个上市产品特瑞普利单抗实现上市销售,公司开始呈现内生“造血”能力。
报告期内,拓益销售收入达7.74亿元,销售毛利88.3%,销售开支占销售收入占比约41.3%。
截至报告期末,公司已建立了超过300人的销售团队,负责拓益及其他在研药品的商业化,销售人员大多曾在跨国药企负责肿瘤药品销售工作,具有丰富的肿瘤药品推广经验。
公司联合北京白求恩公益基金会在全国发起“益路相伴—白求恩·拓益公益捐助项目”,为家庭困难或因病致贫而不能得到持续有效治疗的黑色素瘤患者提供药品援助,以求让更多患者获益。
2
截至目前,君实生物已在全球正在开展超过30个特瑞普利单抗单药治疗及联合治疗的临床试验,包括14项关键注册临床试验。同时,公司结合市场潜力和产品特点,应研究者申请,赞助了研究者发起的临床试验及真实世界研究,持续寻找最佳肿瘤免疫治疗方案。
拓益主要临床试验进展情况
广泛适应症涵盖了发病率较高的肺癌、肝癌、乳腺癌等大适应症,同时也针对多发于亚洲的鼻咽癌、尿路上皮癌、食管癌等特色瘤种。
在美国开展的特瑞普利单抗针对多种实体瘤的Ib期临床试验正在顺利推进中。
2020年3月,特瑞普利单抗与阿昔替尼的联合疗法被美国FDA授予“孤儿药”资格,用于黏膜黑色素瘤的治疗。
3
特瑞普利单抗的研究成果取得了国际学术界的广泛认可。
报告期内,研究团队在《单克隆抗体》(mAbs)、《血液学与肿瘤学杂志》(Journal of Hematology & Oncology)、《肿瘤学年鉴》(Annals of Oncology)、《临床肿瘤学杂志》(Journal of Clinical Oncology)等国际权威刊物上发表成果。
参与一系列权威学术会议,以口头汇报、壁报等形式在美国临床肿瘤协会年会(ASCO)、世界肺癌大会(WCLC)和中国临床肿瘤学会学术年会(CSCO)上发表多瘤种临床试验进展,以及探索性研究成果。
凭借经临床验证的安全性和疗效,特瑞普利单抗被纳入2019年版《CSCO黑色素瘤诊疗指南》。

拓益已公开的部分注册临床相关适应症的临床试验数据
JS004/TAB004(抗BTLA单抗)
公司自主研发的全球首个治疗肿瘤的抗BTLA单抗
1
2019年4月,获得FDA临床试验批准。目前正在美国进行临床I期试验。
2
2020年1月,获得NMPA临床实验,公司随后将制定其国内临床开发策略。
JS002(抗PSCK9单抗)
公司自主研发的首个获得NMPA临床批件的国产PCSK9药物
1
已完成与临床试验中心合作的I期临床试验,确认了JS002的安全性和耐受性。
2
II期临床试验已完成入组,正在进行随访。
3
根据临床研究数据,JS002显示出良好的安全性及耐受性。与同靶点产品相比,未报告任何非预期不良事件。在降低LDL-C方面,显示出与同靶点产品可比的降脂幅度,以及更长的持续时间。
4
正在启动在更广泛患者人群中的III期临床研究的筹备工作。
UBP1211(抗TNF-α单抗,修美乐生物类似药)
公司首款生物类似药,针对包括类风湿性关节炎在内的自身免疫性疾病
1
2019年11月,公司向NMPA提交的新药上市申请获得受理。
JS005(IL-17A单抗)
公司自主研发,针对包括银屑病在内的自身免疫性疾病。JS005的氨基酸序列,特别是CDR区(与靶分子结合区域)的序列与已上市同类单抗的CDR序列不同,为独有的新型结构。
1
2019年8月,获得NMPA核准签发的《药物临床试验通知书》。
2
在临床前研究中,JS005显示出与已上市同类药物相当的疗效和安全性。
3
2020年上半年,预计完成I期临床试验的首例患者入组。
生产设施
生产产能不断提升
公司建有两个符合GMP标准全球领先的单克隆抗体生产基地。其中苏州吴江生产基地拥有3,000L发酵能力并获得GMP认证,正在进行公司产品的商业化生产和临床试验用药的生产。
上海临港生产基地按照cGMP标准建设,并于2019年11月获得了上海市药品监督管理局核准签发的《药品生产许可证》。一期项目拥有30,000L发酵能力,已于2019年底投入试生产。公司引进了全球领先的国际化生产、灌装和检测设备,将严格按计划遵循cGMP进行生产;运用智能化全流程数据交互系统,实现了药物生产全流程的实时管控,确保产品达到国际标准。
公司将进一步提升大分子药物发酵产能、探索新型生产工艺以进一步降低生产成本。

← 左右滑动查看上海临港生产基地内景→
质量管理持续优化
公司始终把产品的质量管理放在突出位置,通过建立一整套标准、流程和规范,为生产优质产品提供有力保障。公司根据实际情况,明确部门和个人工作及职责范围,加强绩效考核,不断改进管理;加强设备使用和维护管理,充分发挥设备技术性能;落实GMP常态化管理,细化各项操作规则,强化员工规则和质量意识,确保药品生产质量合格。
其他业务发展摘要
围绕核心药物抗PD-1单抗,我们在加强自身研发实力的同时,积极与国内外企业、高校开展临床与技术转让及开发合作,开展广泛的创新类型组合与联合用药探索。
1
2019年2月,公司与润佳医药签署技术转让及合作协议,合作开发JS104(泛CDK抑制剂)和JS105(α特异性PI3K抑制剂)。同时,公司享有这两项药物50%的权益。
2
2019年6月,公司与Anwita Biosciences签署股份购买协议和许可协议,以于大中华区开发及商业化AWT008/JS014(一种新IL-21融合蛋白)。
3
2019年6月,公司与华奥泰生物签署《技术转让与合作协议》,从华奥泰生物受让安维汀单抗生物类似药(JS501)的现有研发成果并获得其后续技术支持。目前,JS501已获得NMPA核准签发的《药物临床试验批件》,处于I期临床试验阶段。
4
2019年12月,公司与多禧生物签署《药品开发及许可合同》,通过独占许可授权方式在授权区域内开发及商业化JS108(抗Trop2单抗,ADC药物)。目前,JS108已向NMPA提交临床试验申请并获受理。
5
公司在进行产品授权引进时充分考虑了相关产品的创新性、未来市场潜力以及与公司现有产品的协同。上述授权产品具有较强的创新性和市场潜力,有利于拓展公司产品管线,增强公司创新产品组合类型。
关于君实生物
君实生物(NEEQ:833330,HKEX:01877)于2012年12月由多名毕业于中美两国知名学府、具有丰富跨国科技成果转化及产业经验的团队创办。
君实生物以开发治疗性抗体为主,专注于创新单克隆抗体药物和其他治疗性蛋白药物的研发与产业化。具有丰富的在研产品管线,包括19个创新药,2个生物类似物,覆盖五大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及抗感染疾病。君实生物是第一家获得抗PD-1单克隆抗体NMPA上市批准的中国公司,国内首家就抗PCSK9单克隆抗体和抗BLyS单克隆抗体取得NMPA的IND申请批准的中国公司,并取得了全球首个治疗肿瘤抗BTLA阻断抗体在中国NMPA和美国FDA的IND申请批准。目前在全球拥有超过一千名员工,分布在美国旧金山和马里兰,中国上海、苏州、北京和广州。
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。



















